- Η μεταβολή
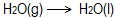 είναι διαδικασία ...
είναι διαδικασία ...- θερμοουδέτερη.
- εξώθερμη ή ενδόθερμη (ανάλογα τις συνθήκες).
- ενδόθερμη.
- εξώθερμη.
- Δίδεται η ισορροπία 2A(g) + B(g)
 2Γ(g), ΔΗ<0.Σε μίγμα ισορροπίας των Α, Β,και Γ θα προκαλέσει αύξηση της ποσότητας του Γ...
2Γ(g), ΔΗ<0.Σε μίγμα ισορροπίας των Α, Β,και Γ θα προκαλέσει αύξηση της ποσότητας του Γ...- η ελάττωση του όγκου του δοχείου υπό σταθερή θερμοκτρασία.
- με αφαίρεση ποσότητας Β υπο σταθερό όγκο και σταθερή θερμοκρασία.
- προσθήκη αδρανούς αερίου (πχ He), υπο σταθερό όγκο και σταθερή θερμοκρασία.
- η αύξηση της θερμοκρασίας.
- Ο βαθμός ιοντισμού του HCOOH σε ένα υδατικό του διάλυμα, θα αυξηθεί όταν ...
- ελαττώσουμε την θερμοκρασία
- προσθέσουμε στο διάλυμα αέριο HCl χωρίς μεταβολή του όγκου και της θερμοκρασίας
- προσθέσουμε επιπλέον νερό στο διάλυμα χωρίς μεταβολή της θερμοκρασίας
- προσθέσουμε στο διάλυμα στερεό HCOONa χωρίς μεταβολή του όγκου και της θερμοκρασίας
- Η σταθερά ιοντισμού ενός ασθενούς οξέος ΗΑ σ’ ένα υδατικό του διάλυμα εξαρτάται από ...
- το pH του διαλύματος.
- τη θερμοκρασία.
- τη συγκέντρωση του ΗΑ.
- την παρουσία κοινού ιόντος.
- Από τα υδραλογόνα HCl (Μr = 36,5), HBr (Mr = 81), HF (Mr = 20), HI (Mr = 128), το μεγαλύτερο σημείο ζέσεως εμφανίζει το ...
- HCl
- HBr
- HI
- HF
- Για την αντίδραση A(g) + 2 B(g)
 2 Γ(g), ο νόμος της ταχύτητας είναι: u=k[A][B]. Αυτό σημαίνει ότι η αντίδραση...
2 Γ(g), ο νόμος της ταχύτητας είναι: u=k[A][B]. Αυτό σημαίνει ότι η αντίδραση...- είναι πρώτης τάξης ως προς το Α.
- είναι απλή.
- είναι τρίτης τάξης.
- είναι δεύτερης τάξης ως προς το Β.
- Η διάκριση της αιθανάλης από την αιθανόλη μπορεί να γίνει με ...
- αντιδραστήριο Fehling
- επίδραση NaOH.
- οξείδωσή τους με οξινισμένο διχρωμικο κάλιο.
- ιωδοφορμική αντίδραση
- Ένας καταλύτης ο οποίος δρα σύμφωνα με την θεωρία των ενδιάμεσων σταδίων ...
- αυξάνει την κινητική ενέργεια των μορίων.
- παρεμποδίζει την αμφίδρομη αντίδραση.
- αυξάνει την απόδοση της αντίδρασης.
- δίνει άλλο μηχανισμό στην αντίδραση.
- Οι χημικοί δεσμοί στο
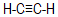 στους οποίους συμμετέχουν sp τροχιακά είναι συνολικά...
στους οποίους συμμετέχουν sp τροχιακά είναι συνολικά...- τέσσερεις
- δύο
- πέντε
- τρεις
- Πιο δραστική από τις καρβονυλικές ενώσεις στις αντιδράσεις προσθήκης είναι ...
- η μεθανάλη
- η αιθανάλη
- η φαινυλομεθανάλη
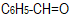
- η προπανόνη
- Σε δοχείο προσθέτουμε ποσότητες από τις ουσίες Α και Β οι οποίες αντιδρούν σύμφωνα με την αντίδραση που περιγράφεται από την χημική εξισωση: 2 A(g) + B(g)
 2 Γ(g), ΔΗ<0. Για να μετατοπιστεί η θέση ισορροπίας προς τα δεξιά πρέπει να ...
2 Γ(g), ΔΗ<0. Για να μετατοπιστεί η θέση ισορροπίας προς τα δεξιά πρέπει να ...- αυξήσουμε την θερμοκρασία και ταυτόχρονα να αυξήσουμε τον όγκο του δοχείου
- αυξήσουμε την θερμοκρασία υπό σταθερό όγκο.
- αυξήσουμε την πίεση με ελάττωση του όγκου του δοχείου υπό σταθερή θερμοκρασία.
- ελαττώσουμε την αρχική ποσότητα του Α υπό σταθερό όγκο και θερμοκρασία.
- Η αντίδραση
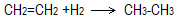 κατατάσσεται στις κατηγορίες αντιδράσεων ...
κατατάσσεται στις κατηγορίες αντιδράσεων ... - προσθήκης και οξειδοαναγωγικές.
- απόσπασης και οξειδοαναγωγικές.
- προσθήκης αλλά όχι οξειδοαναγωγικές.
- υποκατάστασης αλλά όχι οξειδοαναγωγικές.
- Τετράδα κβαντικών αριθμών η οποία είναι δυνατόν να υπάρχει είναι η ...
- (1,0,0,+1/2)
- (1,1,0,-1/2)
- (3,2,3,+1/2)
- (3,0,1,-1/2)
- Υδατικό διάλυμα HCl (Δ1) και υδατικό διάλυμα ΗCOOH (Δ2) έχουν τον ίδιο όγκο και την ίδια τιμή pH στους 25oC. Τότε για την πλήρη εξουδετέρωση ...
- απαιτούν και τα δύο διαλύματα τα ίδια mol NaOH.
- απαιτεί περισσότερα mol NaOH το Δ1.
- απαιτεί περισσότερα mol NaOH το Δ2.
- δεν επαρκούν τα δεδομένα για να αποφασίσουμε πoιο διάλυμα απαιτεί περισσότερα mol NaOH.
- Ασθενής βάση Β ογκομετρείται με πρότυπο διάλυμα HCl. Στο ισοδύναμο σημείο ισχύει ότι το διάλυμα είναι...
- ουδέτερο
- όξινο
- βασικό
- ουδέτερο ή όξινο
- Σε διάλυμα ΗCl το οποίο έχει pH = x προσθέτουμε διάλυμα ΚCl χωρίς μεταβολή της θερμοκρασίας.Το pH του διαλύματος που προκύπτει θα είναι ...
- ίσο με x
- μεγαλύτερο από το x
- μικρότερο από το x
- ίσο ή μεγαλύτερο ή μικρότερο από το x
- Δίδεται η ισορροπία 2Α(g) + B(g)
 Γ(g). Σε κενό δοχείο προσθέτουμε ίσο αριθμό mol των ουσιών Β και Γ και καθόλου Α. Στην ισορροπία θα ισχύει οπωσδήποτε...
Γ(g). Σε κενό δοχείο προσθέτουμε ίσο αριθμό mol των ουσιών Β και Γ και καθόλου Α. Στην ισορροπία θα ισχύει οπωσδήποτε...- [Β]=[Γ]
- [Α]=[Β]
- [Α]<[Γ]
- [Β]>[Γ]
- Το HCl είναι ισχυρότερο οξύ από το HF γιατί...
- το F είναι πιο ηλεκτραρνητικό από το άτομο του Cl.
- το άτομο του Cl έχει μεγαλύτερη ατομική ακτίνα από το άτομο του F.
- η ενέργεια πρώτου ιοντισμού του F είναι μεγαλύτερη από την ενέργεια πρώτου ιοντισμού του Cl.
- στο HCl είναι πιο έντονο το -Ι επαγωγικό φαινόμενο σε σχέση με το ΗF.
- Στα στοιχεία της ομάδας των αλογόνων στο Περιοδικό Πίνακα αυξάνουν από κάτω προς τα πάνω ...
- ο ατομικός αριθμός και η ενέργεια πρώτου ιοντισμού.
- η ηλεκτραρνητικότητα και η ενέργεια πρώτου ιοντισμού.
- η ηλεκτραρνητικότητα και η ατομική ακτίνα
- η ατομική ακτίνα και η ενέργεια πρώτου ιοντισμού.
- Η αύξηση της θερμοκρασίας αυξάνει την ταχύτητα της αντίδρασης επειδή ...
- η συχνότητα των συγκρούσεων μεταξύ των αντιδρώντων μορίων αυξάνει.
- μειώνεται η τιμή της ενέργειας ενεργοποίησης.
- οι δεσμοί των αντιδρώντων μορίων χαλαρώνουν.
- μεγαλύτερο ποσοστό μορίων έχει την ελάχιστη ενέργεια, ώστε να δώσει αποτελεσματικές συγκρούσεις